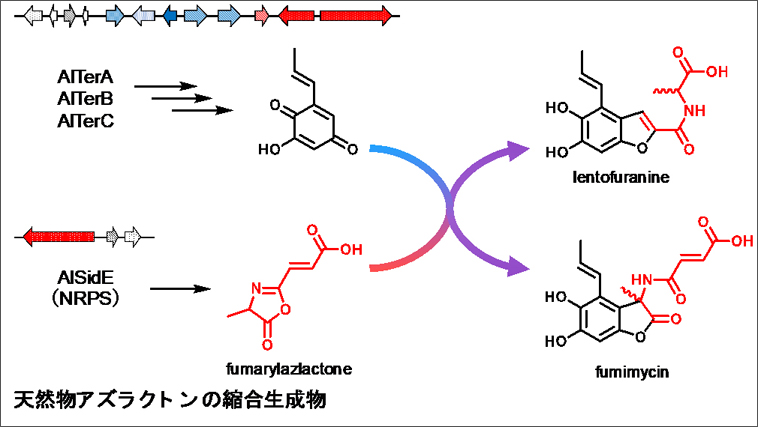
山口エステル化反応(やまぐちエステルかはんのう)は、脂肪族カルボン酸と2,4,6-トリクロロベンゾイルクロリド(TCBC、山口試薬)を反応させて混合酸無水物を形成させ、化学量論量の4-ジメチルアミノピリジン (DMAP) の存在下でアルコールと反応させることにより,所望のエステルを生成させる反応である。1979年、山口勝らによって報告された。
分子間反応においても有用であるが、特に大環状ラクトンの形成に多くの実績を持つ。そのため、特にラクトン化について、山口ラクトン化または山口マクロラクトン化と呼ばれる。マクロライド類の合成において標準的な手法の地位を占め続けている優れた反応である。
反応機構
ラクトン化
ヒドロキシカルボン酸と2,4,6-トリクロロベンゾイルクロリドとをトリエチルアミンなどの塩基の存在下混合し、混合酸無水物とする。この溶液を、4-ジメチルアミノピリジン (DMAP) を含んだ大量の溶媒(高度希釈法)にゆっくりと滴下し、加熱撹拌する。副生成物のトリクロロ安息香酸は、重曹水などによる洗浄によって除去できる。
ベンゾイル基についた3つの塩素原子はその電子求引性によって脱離能を高め、ヒドロキシ基による求核攻撃を受けやすくする役割を負う。また立体障害を高めることによって、ヒドロキシ基がベンゾイル基側のカルボニル基を攻撃しないようにする役目も併せ持つ。
エステル化
脂肪族カルボン酸イオンがDMAPおよびアルコールよりも求核性が高く、脂肪族カルボン酸無水物が混合酸無水物よりも求電子性が高い事実に基づき、脂肪族カルボン酸の反応において見られる位置選択性を説明するために、in situで対称型脂肪族カルボン酸無水物が生成している反応機構が提唱されている。
関連反応
椎名勇らによって開発された2-メチル-6-ニトロ安息香酸無水物(MNBA)を脱水縮合剤とする環化反応(椎名ラクトン化反応)は、平衡的に混合酸無水物を系内で発生させる手段でありその濃度を低く保つことができるため、山口法よりよい結果を与えることが多く近年使用例が増えている。
脚注
関連項目
- 光延反応